我们来聊聊中国的临床试验注册(Clinical Trial Registration)。这是一个在药物、医疗器械以及某些健康相关干预措施的研发和审批过程中至关重要的环节。
简单来说,临床试验注册是指"在临床试验开始招募受试者之前,将试验的核心信息(设计、目的、方法、参与者等)在一个公开的、指定的注册平台上进行登记记录的行为"。
以下是关于中国临床试验注册的一些关键知识点:
1. "为什么需要临床试验注册? (Why?)"
"提高透明度 (Transparency):" 使公众、研究人员、监管机构等能够了解正在进行的临床试验,特别是那些可能涉及风险较大的试验。
"防止重复研究 (Preventing Duplication):" 通过公开信息,可以避免不同研究团队对相同问题进行重复的研究,节约资源。
"确保研究质量 (Ensuring Quality):" 注册过程要求研究者提交详细的试验方案信息,有助于规范研究设计,提高研究的科学性和可靠性。
"满足法规要求 (Regulatory Requirement):" 许多国家(包括中国)和国际指南(如ICH-GCP)都要求或强烈建议进行临床试验注册。对于药品审批,国家药品监督管理局(NMPA)已将试验注册作为上市申请的必要条件之一。
"促进数据共享与比较 (Promoting Data Sharing & Comparison):" 公开注册信息有助于后续对试验结果的系统评价(Systematic Review)和 Meta 分析,为临床决策提供
相关内容:
尔云间 一个专门做科研的团队
小薇 A科研显微镜 ✦++ 关注我们
你有没有在投临床类SCI文章的时候遇到审稿人或者杂志编辑需要你提供临床注册号的?比如:观察性研究、诊断性研究、干预性研究等,看到意见的那一刻有没有觉得自己其实不是很懂临床试验注册相关的信息和流程,别慌,今天小微就带大家来熟悉一下~
1. 为什么临床试验需要注册?
临床试验注册是医学研究伦理的需要,是临床试验研究者的责任和义务。
2. 什么样的临床研究需要注册?
所有在人体中和采用取自人体的标本进行的研究,包括各种干预措施的疗效和安全性的有对照或无对照试验(如随机对照试验、病例-对照研究、队列研究及非对照研究)、预后研究、病因学研究、和包括各种诊断技术、试剂、设备的诊断性试验,均需注册并公告。
3. 注册是否需要费用?
不需要。中国临床试验注册中心为非赢利机构,一律免费注册;补注册试验的注册本身是免费的,但需交纳数据审核和数据库维护费。
4. 中、英文双语注册
所有在中国实施的临床试验均需采用中、英文双语注册,包括中国大陆、台湾和香港特别行政区、澳门特别行政区。其中,来自于香港特别行政区的研究者如果使用中文确有困难,可在中文栏内填入英文。中国以外的其他国家和地区均使用英文注册。
在上传完整的中、英文注册资料后可获得注册号,获得注册号后一周内(特殊情况除外)可在世界卫生组织国际临床试验注册平台检索入口(WHO ICTRP search portal)检索到已注册试验。
5. 应在何时注册临床试验?
应在募集第一名受试者之前注册试验。有的注册机构可能在注册之前要求提供伦理委员会的批文,而有的伦理委员会可能在颁发批文之前要求先注册试验。为了兼顾此两种情况,中国临床试验注册中心采取对已获得伦理委员会审查批准或尚未获得批准的试验均 予注册,对在注册时尚未获得伦理批准的试验要求在获得伦理委员会批准立即补充提交伦理委员会批件扫描件。
6. 注册流程
(1)用户注册
登录中国临床试验注册中心(
http://www.chictr.org.cn/index.aspx)进行注册
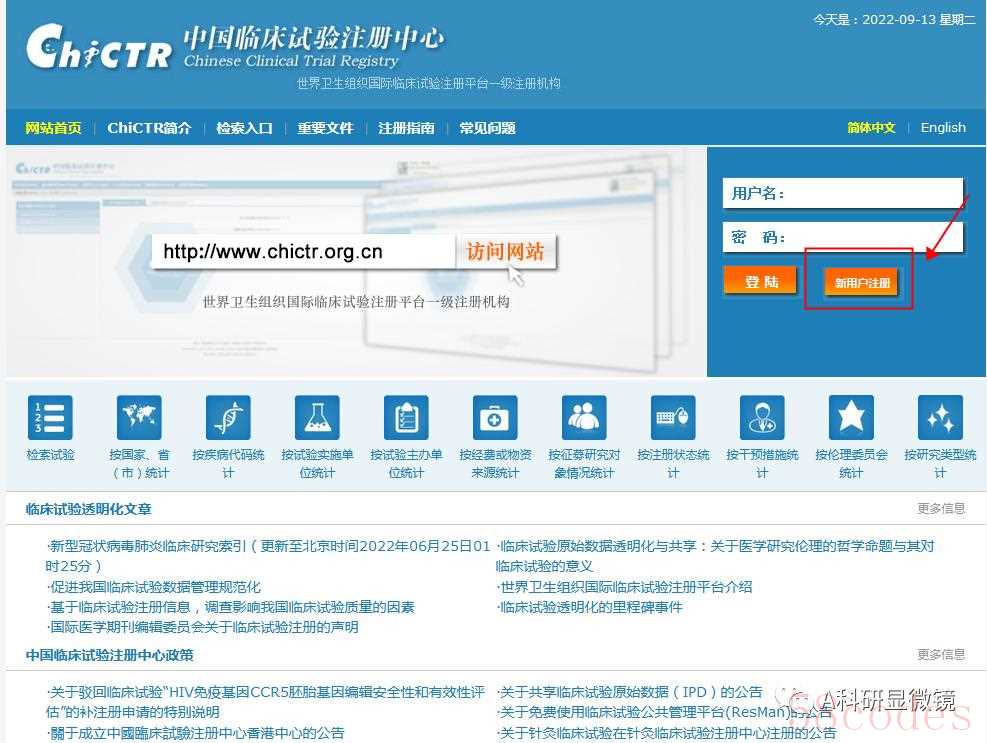
注册的时候会出现以下界面,带“*”的问题需要全部填写

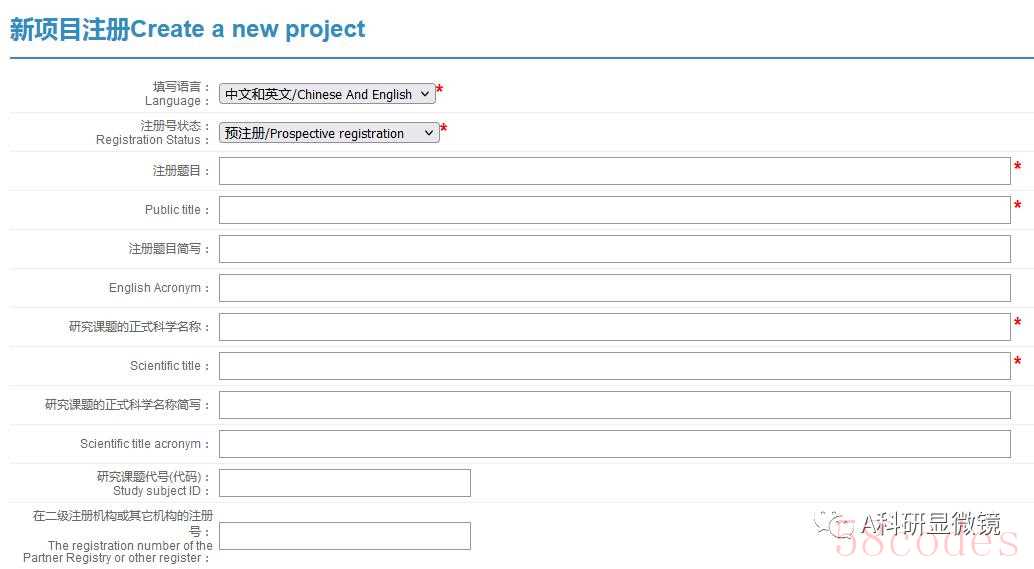
(2)创建新项目
首先登录注册的账号,然后点击“新注册项目”

之后就按照研究方案逐步填写,这里主要分为以下几个板块:
注册题目板块(注册题目、研究课题等信息)
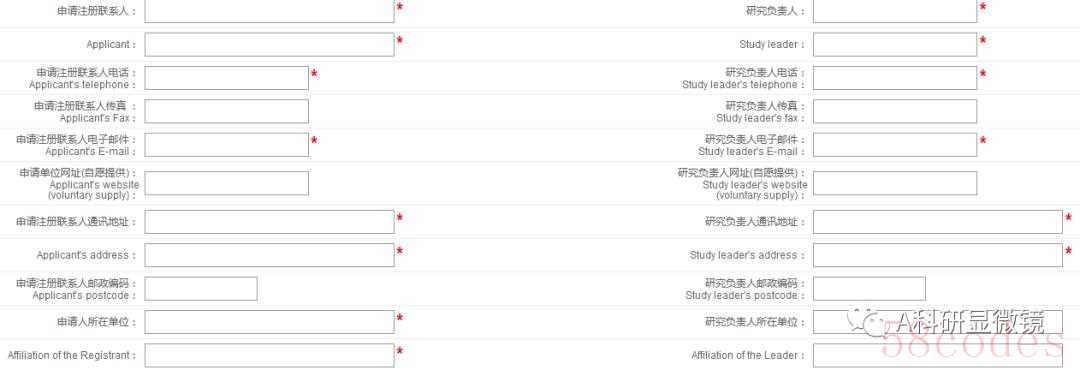
申请注册人信息板块(注册单位、人员等详细信息)
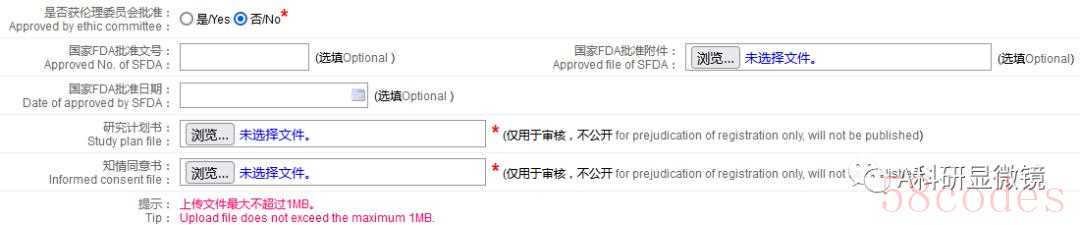
伦理、知情同意板块(填写具体伦理审批号、单位等信息)
研究方案板块(根据研究方案填写即可,主要包括目的、纳入排除标准、干预措施等)
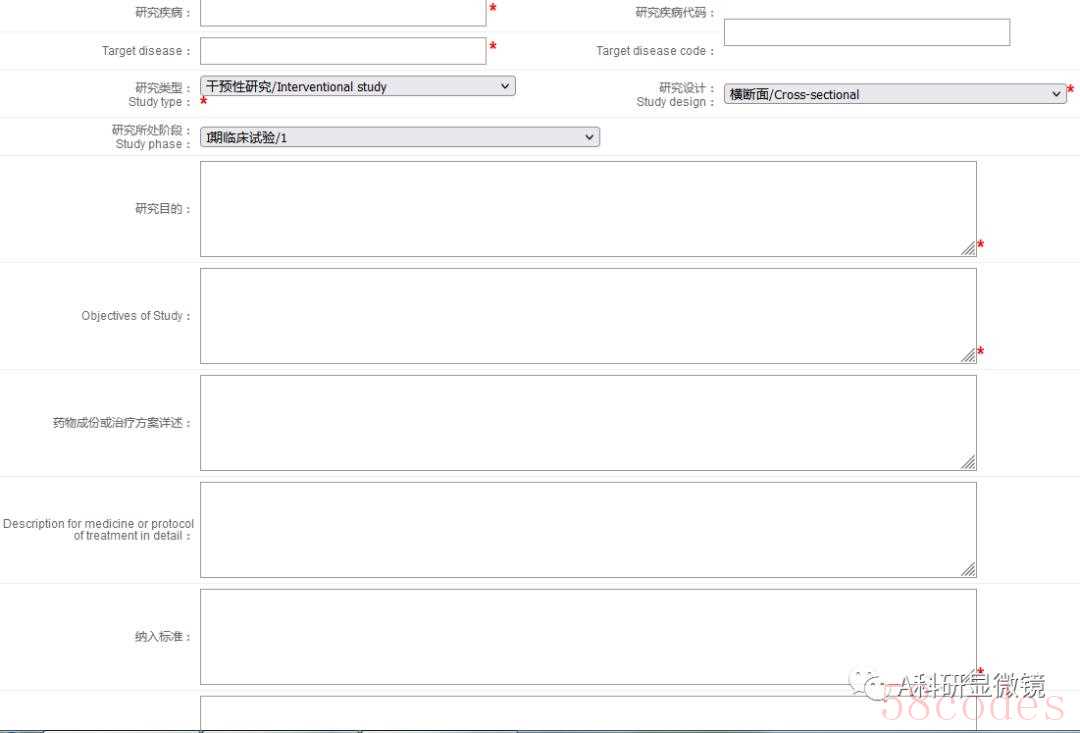

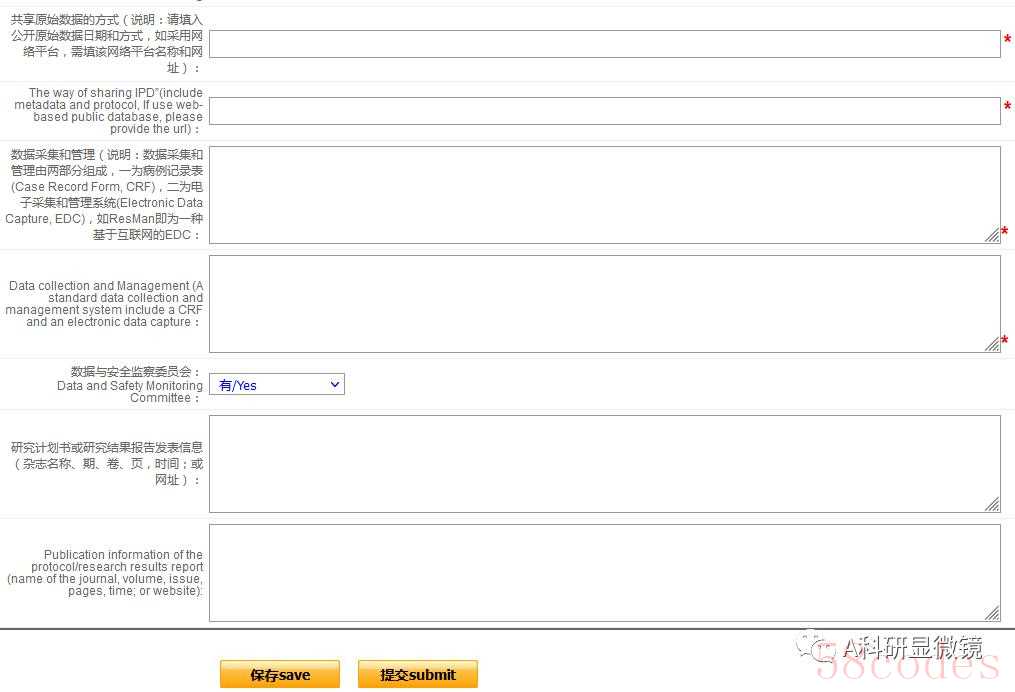
(3)等待审核
填写好新项目信息后,点击提交,接下来就是等待审核的过程,如若资料合格,审核完成后,自提交注册表之日起两周内会通过审核,之后即可获得注册号,需要时刻关注自己的邮箱
(4)注册模板参考
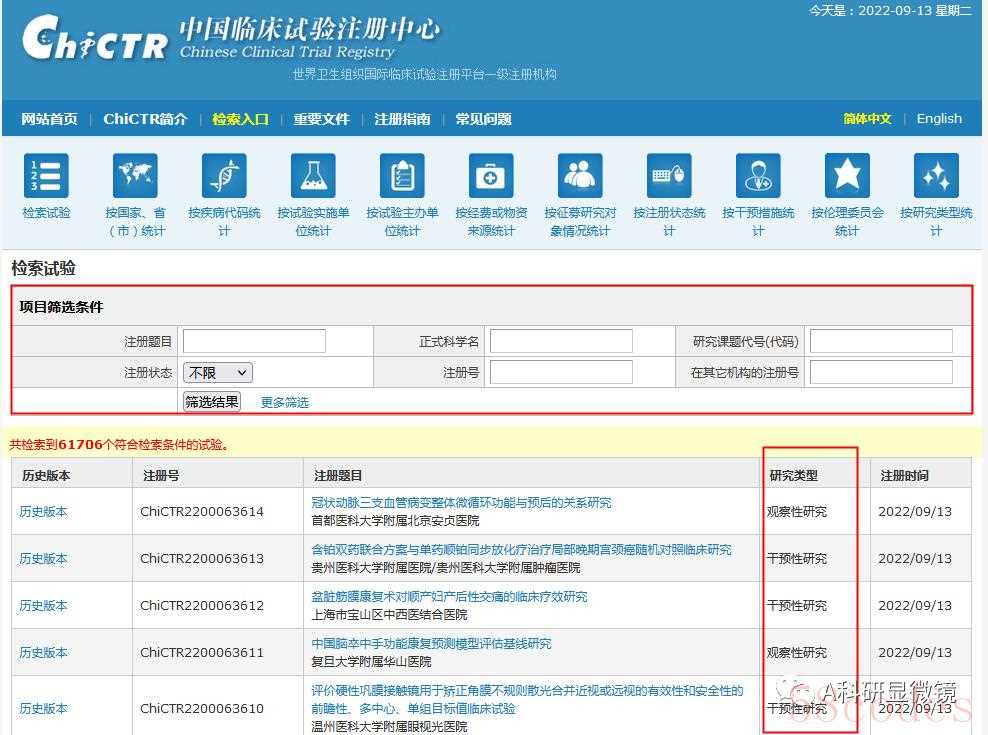
如若不知道怎么填写,需要参考的话,可以进入检索界面,在项目筛选条件板块输入相关内容查找与自己项目类似的研究,参考着填写即可
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏
